Enzimele - Informatii generale si originea acestora
Enzimele (din limba greacă - zymosis - ferment) sunt proteine sau proteide fără de care celule vii nu pot înfăptui reacţii complexe într-un timp scurt, la temperatura mediului înconjurător.Ele sunt substanţe care catalizează reacţiile biochimice din organism, avînd un rol esenţial în biosinteza şi degradarea substanţelor din materia vie, întîlnindu-se în toate organismele animale, vegetale şi în microorganisme, mai fiind denumite din această cauză biocatalizatori.Fără enzime , procesele biochimice s-ar desfăşura cu viteze foarte mici.
Consideraţii generale
Incă din anul 1700 şi mai tîrziu 1800 s-a observat digestia cărnii de către sucurile gastrice, conversia amidonului în zahăr sub acţiunea salivei, dar în secolul IX Louis Pasteur, pe cînd studia fermentaţia zahărului în alcool în prezenţa drojdiei de bere junge la concluzia că acest proces de fermentaţie se datoreşte prezenţei în drojdia de bere a ceea ce numeşte "ferment", care are activitate numai în interiorul organismelor vii:
"alcoholic fermentation is an act correlated with the life and organisation of the yeast cells, not with the death or putrefaction of the cells."
"Fermentaţia alcoolică este un act corelat cu organizarea celulelor vii din drojdia de bere, nu cu moartea sau putrefacţia celulelor"
Rol în cadrul organismelor
* Descompunerea moleculelor mari;
* Accelerează procesele metabolice;
* Coordonează unele etape ale ciclului metabolic.
Structura enzimelor
Enzimele sunt substante de natură proteică. Acestea reprezintă macromolecule, compuse din lanţuri polipeptidice, având o masă moleculară între 10.000 - 1.000.000.
Mecanismul reactiei
Enzima formează cu substratul un produs intermediar reactiv, cu o viaţă scurtă. Sub această formă intermediară, substratul intrat în reacţie suferă modificări electronice sub acţiunea centrilor activi ai enzimei, rezultând produsul de reacţie.
Temperatura
La creşterea temperaturii creşte şi activitatea enzimatică. La temperaturi însă prea mari, enzimele încep să se descompună şi activitatea enzimatică se micşorează.
pH
Activitatea enzimatică este în strânsă legătură cu pH-ul mediului în care se află. De exemplu, pepsină, o enzimă digestivă, este în condiţii optime la pH cuprins între 1,5 - 2.
Cofactorii
Combinaţia dintre enzimă şi cofactorul dat (coenzima sau ionul metalic) reprezintă o configuraţie activă, cu care substratul poate fi mai uşor reacţionat.
Ionii metalici
Ca si cofactori mai pot fi prezenţi ionii anumitor metale, care sunt legaţi strans de enzimă. Cei mai răspândiţi ioni metalici sunt: ionul bivalent de Zn, ionul bivalent de Fe, ionul bivalent de Co şi Mn.
Tipuri de enzime
După reactivitate
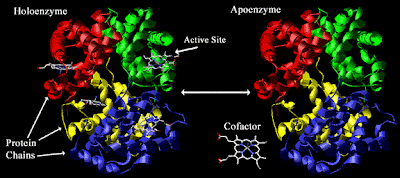
* Apoenzimă - enzimă, care devine activă numai la unirea cu anumite substanţe de natură non-proteică;
* Coenzimă sau cofactor - substanţă de natură non-proteică, ce-i conferă activitate enzimatică apoenzimei;
* Holoenzimă - macromolecula rezultată în urma unirii coenzimei cu o apoenzima.
După natura substratului
* Oxidoreductază;
* Transferază;
* Hidrolază;
* Liază;
* Isomerază;
* Ligază.
Nomenclatura
Nomenclatura enzimelor nu este dificilă. Aceasta se bazează pe 2 factori:
* substratul asupra căruia acţionează enzima:
* cum reacţionează enzima cu substratul dat.
De exemplu: piruvat decarboxilază - enzima care îndepărtează grupa carboxil de la piruvat.
Boli metabolice
Sunt numeroase boli metabolice, cauzate de absenţa unei enzime sau funcţionarea proastă a unei enzime în corpul uman.
SURSA 03
Consideraţii generale
Incă din anul 1700 şi mai tîrziu 1800 s-a observat digestia cărnii de către sucurile gastrice, conversia amidonului în zahăr sub acţiunea salivei, dar în secolul IX Louis Pasteur, pe cînd studia fermentaţia zahărului în alcool în prezenţa drojdiei de bere junge la concluzia că acest proces de fermentaţie se datoreşte prezenţei în drojdia de bere a ceea ce numeşte "ferment", care are activitate numai în interiorul organismelor vii:
"alcoholic fermentation is an act correlated with the life and organisation of the yeast cells, not with the death or putrefaction of the cells."
"Fermentaţia alcoolică este un act corelat cu organizarea celulelor vii din drojdia de bere, nu cu moartea sau putrefacţia celulelor"
Rol în cadrul organismelor
* Descompunerea moleculelor mari;
* Accelerează procesele metabolice;
* Coordonează unele etape ale ciclului metabolic.
Structura enzimelor
Enzimele sunt substante de natură proteică. Acestea reprezintă macromolecule, compuse din lanţuri polipeptidice, având o masă moleculară între 10.000 - 1.000.000.
Mecanismul reactiei
Enzima formează cu substratul un produs intermediar reactiv, cu o viaţă scurtă. Sub această formă intermediară, substratul intrat în reacţie suferă modificări electronice sub acţiunea centrilor activi ai enzimei, rezultând produsul de reacţie.
Temperatura
La creşterea temperaturii creşte şi activitatea enzimatică. La temperaturi însă prea mari, enzimele încep să se descompună şi activitatea enzimatică se micşorează.
pH
Activitatea enzimatică este în strânsă legătură cu pH-ul mediului în care se află. De exemplu, pepsină, o enzimă digestivă, este în condiţii optime la pH cuprins între 1,5 - 2.
Cofactorii
Combinaţia dintre enzimă şi cofactorul dat (coenzima sau ionul metalic) reprezintă o configuraţie activă, cu care substratul poate fi mai uşor reacţionat.
Ionii metalici
Ca si cofactori mai pot fi prezenţi ionii anumitor metale, care sunt legaţi strans de enzimă. Cei mai răspândiţi ioni metalici sunt: ionul bivalent de Zn, ionul bivalent de Fe, ionul bivalent de Co şi Mn.
Tipuri de enzime
După reactivitate
* Apoenzimă - enzimă, care devine activă numai la unirea cu anumite substanţe de natură non-proteică;
* Coenzimă sau cofactor - substanţă de natură non-proteică, ce-i conferă activitate enzimatică apoenzimei;
* Holoenzimă - macromolecula rezultată în urma unirii coenzimei cu o apoenzima.
După natura substratului
* Oxidoreductază;
* Transferază;
* Hidrolază;
* Liază;
* Isomerază;
* Ligază.
Nomenclatura
Nomenclatura enzimelor nu este dificilă. Aceasta se bazează pe 2 factori:
* substratul asupra căruia acţionează enzima:
* cum reacţionează enzima cu substratul dat.
De exemplu: piruvat decarboxilază - enzima care îndepărtează grupa carboxil de la piruvat.
Boli metabolice
Sunt numeroase boli metabolice, cauzate de absenţa unei enzime sau funcţionarea proastă a unei enzime în corpul uman.
SURSA 02
1. Generalitati
Enzimele sunt catalizatori biochimici propriu-zisi, asadar sunt compusi care maresc viteza reactiilor chimice ce se desfasoara in sistemele biologice, fara sa se consume in cursul lor.
Din cea mai indepartata antichitate sunt cunoscute procese enzimatice cun sunt fermen-tatia vinului, dospirea painii etc. Dar cunostinte sistematice in acest domeniu s-au obtinut incepand cu identificarea primelor enzime: amilaza din malt(Kirchoff, 1814), amilaza sali-vara(Leuchs, 1831) si pepsina(Schwann, 1836). Ulterior, progrese importante s-au realizat prin lucrarile privind cataliza si biocataliza ale lui Berzelius Liebig, prin studiile asupra cineticii ale lui Michaelis si Menten(1912), prin obtinerea enzimelor in stare cristali-zata(Sumner, 1926).
S-au efectuat lucrari numeroase de-a lungul anilor dovedindu-se prin acestea ca enzi-mologia constituie studiul bazelor moleculare ale vietii.
2. Mecanismul de actiune al enzimelor. Centri activi
Se stie ca intr-un sistem chimic nu toate moleculele reactioneaza cu aceeasi viteza. Moleculele care reactioneaza se gasesc pe un nivel energetic superior celui pe care se gas-esc moleculele obisnuite. Diferenta de energie dintre moleculele active si cele pasive poarta numele de energie de activare.
Un catalizator este o substanta care, prin prezenta ei, determina intr-o substanta sau un amestec de substante o reactie ce nu are loc in absenta ei(definitie dupa Berzelius, 1836) sau care mareste viteza unei reactii, ce are loc si in absenta ei, dar cu viteza mai mica, eventual imperceptibila(definitie dupa Ostwald, 1894). Catalizatorul se regaseste neschimbat, calita-tiv si cantitativ, dupa reactie. Aparent catalizatorul nu ia parte la reactie.
Este necesar sa se accentueze caracterul de substante al catalizatorilor. Ar fi gresit sa se vorbeasca de actiunea catalitica a unei forme de energie, caldura, lumina sau electricitate.
Se numeste substrat substanta sau amestecul de substante asupra carora actioneaza un catalizator.
Catalizatorii determina sau accelereaza numai reactii termodinamic posibile, adica reactii decurgand spontan, cu cresterea entalpiei libere de reactie, in sensul stabilirii unui echilibru. Exista catalizatori(MnO2,NaOH) care accelereaza transformarea ozonului, O3 in O2, dar nu exista un catalizator care sa produca ozon din oxigen.
Aceasta scadere a energiei de activare se datoreaza formarii unui “complex activat” intre catalizator si reactant, pentru care energia de activare este mult mai mica.
In cazul catalizei enzimatice, intre enzima si substratul care se transforma, se formeaza un complex activat enzima-substrat, care apoi se transforma cu viteza mare in produsii fi-nali de reactie.
La formarea complexului activat enzima -; substrat, substratul se fixeaza pe regiuni bine determinate de pe suprafata enzimei, care poarta numele de centri activi si molecula sub-stratului, exista complementaritati conformationale si chimice care permit asamblarea lor.
Centrul activ al unei enzime este construit dintr-un numar redus de aminoacizi situati in vecinatate sau la distanta. In general, se admite ca pentru o reactie chimica obisnuita, en-zima participa cu doi centri activi. Pentru enzimele cu structura binara unul dintre centrii activi este, in general, situat in fragmentul protetic, iar al doilea in fragmentul prostetic.
Pentru reactiile care prezinta specificitate stereochimica se admite ca fixarea subtratului pe enzima se face prin intermediul a 3 centri activi.
Fixarea substratului pe enzima ii imprima acestuia o stare de tensiune moleculara care faciliteaza reactia biochimica, sau orienteaza favorabil una in raport cu cealalta, moleculele ce urmeaza sa reactioneze.
Desi actiunea enzimelor este catalitica, enzimele prezinta unele caractere care le diferen-tiaza de catalizatorii tipici.
Astfel, cataliza enzimatica are elemente comune cu cataliza homogena deoarece enzima este adeseori repartizata uniform in sistemul chimic al carui transformare o asigura. Cataliza enzimatica are caracter si de cataliza eterogena, reactia biochimica desfasurandu-se in regi-uni bine determinate de pe suprafata enzimei, situate la limita de separare dintre sistemul reactant si macromolecula catalizatorului.
Un alt caracter tipic este marea eficienta catalitica a enzimelor. O reactie decurge in prezenta enzimei de 108 pana la 1011 ori mai repede decat in absenta ei. Numarul de mole-cule de substrat transformate sub actiunea enzimei intr-un minut(numar de transfer, turn-over) variaza intre 1 000 -; 1 000 000.
Cataliza enzimatica are loc in conditii blande. Reactii care necatalizate nu au loc decat la temperaturi inalte, presiuni mari, valori extreme de pH, sub influenta enzimelor evolueaza cu mare viteza la temperaturi in jurul lui 37º, la presiune atmosferica, la pH aproape neutru.
Enzimele se caracterizeaza printr-o remarcabila specificitate in raport cu tipul de reactie catalizat si cu natura substratului transformat. Sunt unele enzime(ureaza, arginaza) care nu catalizeaza decat o singura reactie bine determinata.
Remarcabila este de asemenea multitudinea reactiilor catalizate de enzime. Astfel, en-zimele intervin in reactii de hidroliza, de polimerizare si policondensare, de oxidoreducere, de transfer de grupari functionale(formil, metil, amino, acil, carboxil), de formare si scin-dare de legaturi covalente, de reactii prin radicali liberi etc.
Unele cracteristici ale enzimelor sunt imprimate de structura lor proteica. Astfel, activi-tatea lor in cursul metabolismului intermediar este limitata in timp. Ele se degradeaza rela-tiv rapid sub influenta altora. Activitatea, degradarea si biosinteza enzimelor, sunt reglate de factori si mecanisme de control, de complexitate deosebita si situate la nivele variate de or-ganizare a sistemelor biologice.
3. Exemple de reactii catalitice
a. Peroxidul de hidrogen, H2O2, in solutie apoasa de 3%, se descompune la 100º in H2O si O2, dar este stabil, un timp foarte lung, luni sau ani, la temperatura camerei. O cantitate foarte mica de platina coloida face ca reactia sa aiba la loc la temperatura camerei. Sunt suficiente cantitati foarte mici de catalizator; 1 mg de platina coloida in 105 litri solutie H2O2 determina o degajare imensa de O2, iar activitatea catalizatorului ramane aceeasi dupa ce se dezvolta 10 litri din acest gaz. Un catalizator mai puternic inca este catalaza, o enzima care se gaseste in sange si in tesuturile vii. O molecula de catalaza descompune 5 x 106 molecule H2O2 pe minut, la temperatura obisnuita.
b. Modificarea vitezei de reactie de catre catalizator si obtinerea de produsi de reactie diferiti cu catalizatori diferiti dovedeste participarea catalizatorului la reactie. Cataliza-torl reactioneaza cu unul din reactanti sau cu ambii; intermediarul nestabil rezultat sufera o reactie in care ia nastere produsul de reactie si totodata se regenereaza catalizatorul in aceeasi stare ca la inceput.
1. Generalitati
Enzimele sunt catalizatori biochimici propriu-zisi, asadar sunt compusi care maresc viteza reactiilor chimice ce se desfasoara in sistemele biologice, fara sa se consume in cursul lor.
Din cea mai indepartata antichitate sunt cunoscute procese enzimatice cun sunt fermen-tatia vinului, dospirea painii etc. Dar cunostinte sistematice in acest domeniu s-au obtinut incepand cu identificarea primelor enzime: amilaza din malt(Kirchoff, 1814), amilaza sali-vara(Leuchs, 1831) si pepsina(Schwann, 1836). Ulterior, progrese importante s-au realizat prin lucrarile privind cataliza si biocataliza ale lui Berzelius Liebig, prin studiile asupra cineticii ale lui Michaelis si Menten(1912), prin obtinerea enzimelor in stare cristali-zata(Sumner, 1926).
S-au efectuat lucrari numeroase de-a lungul anilor dovedindu-se prin acestea ca enzi-mologia constituie studiul bazelor moleculare ale vietii.
2. Mecanismul de actiune al enzimelor. Centri activi
Se stie ca intr-un sistem chimic nu toate moleculele reactioneaza cu aceeasi viteza. Moleculele care reactioneaza se gasesc pe un nivel energetic superior celui pe care se gas-esc moleculele obisnuite. Diferenta de energie dintre moleculele active si cele pasive poarta numele de energie de activare.
Un catalizator este o substanta care, prin prezenta ei, determina intr-o substanta sau un amestec de substante o reactie ce nu are loc in absenta ei(definitie dupa Berzelius, 1836) sau care mareste viteza unei reactii, ce are loc si in absenta ei, dar cu viteza mai mica, eventual imperceptibila(definitie dupa Ostwald, 1894). Catalizatorul se regaseste neschimbat, calita-tiv si cantitativ, dupa reactie. Aparent catalizatorul nu ia parte la reactie.
Este necesar sa se accentueze caracterul de substante al catalizatorilor. Ar fi gresit sa se vorbeasca de actiunea catalitica a unei forme de energie, caldura, lumina sau electricitate.
Se numeste substrat substanta sau amestecul de substante asupra carora actioneaza un catalizator.
Catalizatorii determina sau accelereaza numai reactii termodinamic posibile, adica reactii decurgand spontan, cu cresterea entalpiei libere de reactie, in sensul stabilirii unui echilibru. Exista catalizatori(MnO2,NaOH) care accelereaza transformarea ozonului, O3 in O2, dar nu exista un catalizator care sa produca ozon din oxigen.
Aceasta scadere a energiei de activare se datoreaza formarii unui “complex activat” intre catalizator si reactant, pentru care energia de activare este mult mai mica.
In cazul catalizei enzimatice, intre enzima si substratul care se transforma, se formeaza un complex activat enzima-substrat, care apoi se transforma cu viteza mare in produsii fi-nali de reactie.
La formarea complexului activat enzima -; substrat, substratul se fixeaza pe regiuni bine determinate de pe suprafata enzimei, care poarta numele de centri activi si molecula sub-stratului, exista complementaritati conformationale si chimice care permit asamblarea lor.
Centrul activ al unei enzime este construit dintr-un numar redus de aminoacizi situati in vecinatate sau la distanta. In general, se admite ca pentru o reactie chimica obisnuita, en-zima participa cu doi centri activi. Pentru enzimele cu structura binara unul dintre centrii activi este, in general, situat in fragmentul protetic, iar al doilea in fragmentul prostetic.
Pentru reactiile care prezinta specificitate stereochimica se admite ca fixarea subtratului pe enzima se face prin intermediul a 3 centri activi.
Fixarea substratului pe enzima ii imprima acestuia o stare de tensiune moleculara care faciliteaza reactia biochimica, sau orienteaza favorabil una in raport cu cealalta, moleculele ce urmeaza sa reactioneze.
Desi actiunea enzimelor este catalitica, enzimele prezinta unele caractere care le diferen-tiaza de catalizatorii tipici.
Astfel, cataliza enzimatica are elemente comune cu cataliza homogena deoarece enzima este adeseori repartizata uniform in sistemul chimic al carui transformare o asigura. Cataliza enzimatica are caracter si de cataliza eterogena, reactia biochimica desfasurandu-se in regi-uni bine determinate de pe suprafata enzimei, situate la limita de separare dintre sistemul reactant si macromolecula catalizatorului.
Un alt caracter tipic este marea eficienta catalitica a enzimelor. O reactie decurge in prezenta enzimei de 108 pana la 1011 ori mai repede decat in absenta ei. Numarul de mole-cule de substrat transformate sub actiunea enzimei intr-un minut(numar de transfer, turn-over) variaza intre 1 000 -; 1 000 000.
Cataliza enzimatica are loc in conditii blande. Reactii care necatalizate nu au loc decat la temperaturi inalte, presiuni mari, valori extreme de pH, sub influenta enzimelor evolueaza cu mare viteza la temperaturi in jurul lui 37º, la presiune atmosferica, la pH aproape neutru.
Enzimele se caracterizeaza printr-o remarcabila specificitate in raport cu tipul de reactie catalizat si cu natura substratului transformat. Sunt unele enzime(ureaza, arginaza) care nu catalizeaza decat o singura reactie bine determinata.
Remarcabila este de asemenea multitudinea reactiilor catalizate de enzime. Astfel, en-zimele intervin in reactii de hidroliza, de polimerizare si policondensare, de oxidoreducere, de transfer de grupari functionale(formil, metil, amino, acil, carboxil), de formare si scin-dare de legaturi covalente, de reactii prin radicali liberi etc.
Unele cracteristici ale enzimelor sunt imprimate de structura lor proteica. Astfel, activi-tatea lor in cursul metabolismului intermediar este limitata in timp. Ele se degradeaza rela-tiv rapid sub influenta altora. Activitatea, degradarea si biosinteza enzimelor, sunt reglate de factori si mecanisme de control, de complexitate deosebita si situate la nivele variate de or-ganizare a sistemelor biologice.
3. Exemple de reactii catalitice
a. Peroxidul de hidrogen, H2O2, in solutie apoasa de 3%, se descompune la 100º in H2O si O2, dar este stabil, un timp foarte lung, luni sau ani, la temperatura camerei. O cantitate foarte mica de platina coloida face ca reactia sa aiba la loc la temperatura camerei. Sunt suficiente cantitati foarte mici de catalizator; 1 mg de platina coloida in 105 litri solutie H2O2 determina o degajare imensa de O2, iar activitatea catalizatorului ramane aceeasi dupa ce se dezvolta 10 litri din acest gaz. Un catalizator mai puternic inca este catalaza, o enzima care se gaseste in sange si in tesuturile vii. O molecula de catalaza descompune 5 x 106 molecule H2O2 pe minut, la temperatura obisnuita.
b. Modificarea vitezei de reactie de catre catalizator si obtinerea de produsi de reactie diferiti cu catalizatori diferiti dovedeste participarea catalizatorului la reactie. Cataliza-torl reactioneaza cu unul din reactanti sau cu ambii; intermediarul nestabil rezultat sufera o reactie in care ia nastere produsul de reactie si totodata se regenereaza catalizatorul in aceeasi stare ca la inceput.
SURSA 03
Reactiile enzimatice au fost folosite din timpurile cele mai vechi pentru fabricarea vinului, a otetului, a berii si a branzei. O cercetare sistematica a lor a fost intreprinsa abia in epoca moderna. În 1713, Réaumur a observat dizolvarea carnii in sucul stomacal al ciorii. De asemenea, fiziologul Spallanzani (1783) a hranit animalele cu bucati de carne invelite in retele de sarma si a observat dizolvarea carnii in stomac.
Stahl, fondatorul teoriei flogisticului, explica fermenatia ca un proces in care una din substantele prezente transmite "miscarea sa interna" substantei care fermenteaza (1697). În 1680, van Leeuwenhoeck a observat la microscop celulele drojdiei de bere, dar aceasta descoperire nu a fost luata in seama timp de doua secole. Lavoisier (1789) a facut un bilant de materiale al fermentatiei, aratand ca oxigenul, hidrogenul si carbonul din zahar se regasesc in alcoolul si bioxidul de carbon ce iau nastere. Continuarea acestor idei a condus la ecuatia lui Gay-Lussac a fermentatiei alcoolice.
Cagnard-Latour si, simultan si independent, Kützing (1838) au atribuit fermentatia alcoolica celulelor din drojdie, considerate ca fiinte vii, probabil de natura vegetala. În aceste observatii isi are originea teoria vitalista a fermentatiei. Sustinatorul principal al acestei teorii, Pasteur, a publicat in 1857 cercetarea sa celebra asupra fermentatiei alcoolice, in care sustine sau sugereaza ca fermentatia este un proces legat direct de metabolismul celulelor drojdiei. Liebig (1839) considera dimpotriva ca fermentatia este o descompunere a zaharului, datorita unor vibratii moleculare provocate de fenomenele chimice din celulele vii ale drojdiei.
În jumatatea a doua a secolului al IXX-lea, in urma lucrarilor lui Pasteur, multi chimisti faceau deosebire intre fermentii formati sau figurati presupusi legati inseparabil de anumite elemente din celule sau chiar considerati identici cu celula vie, si fermenti neformati sau solubili, de tipul acelora din sucurile digestive sau din extractele apoase ale diferitelor materiale biologice. Fermentii neformati sunt deci substante care isi exercita actiunea si in afara celulei vii. Termenul enzima, pentru a desemna fermentii neformati, a fost introdus de Kühne, in 1878.
Buchner (1897) a izolat din drojdia de bere un suc liber de orice celula si totusi capabil sa provoace fermentatia. Acest suc contine deci o enzima pe care Buchner a numit-o zimaza. Aceasta este de fapt un amestec de mai multe enzime, dupa cum s-a dovedit mai tarziu. În urma acestor descoperiri, deosebirea dintre termenii ferment si enzima a pierdut semnificatia sa. În cursul secolului al IXX-lea, au fost preparate multe extracte de enzime. Astfel, dupa ce Kirchoff a observat, in 1820, ca o componenta glutinoasa din bobul de orez incoltit, numit malt, transforma cantitati de amidon mult mai mari decat propria sa greutate, intr-un zahar solubil, maltoza, Dubrunfaut a gasit, in 1830, ca extractul apos, limpede, de malt are aceeasi actiune solubilizanta asupra amidonului ca maltul insusi. Din acest extract, Payen si Persoz (1833) au izolat prin precipitare cu etanol, prima enzima, amilaza, sub forma unui material solid alb, amorf, capabil sa solubilizeze o cantitate de amidon de 2000 de ori mai mare decat propria sa greutate. În 1830, Robiquet si Boutron-Chalard au descoperit hidroliza amigdalinei, cu extract de migdale amare, iar in 1837, Liebig si Wöhler au izolat enzima respectiva, numind-o emulsina. Printre primele enzime izolate, vom mai mentiona: pepsina din sucul gastric (Schwann, 1836); trepsina din sucul pancreatic (Kühne, 1848); lipaza (Claude Bernard , 1849); invertaza (Mitscherlich, 1841; Berthelot, 1860); ureeaza (Musculus, 1882), etc.
Un moment istoric deosebit de important este recunoasterea clara, de catre Berzelius, in 1835, a caracterului catalitic al reactiilor enzimatice, precum si a rolului esential pentru viata animalelor si a plantelor jucat de aceste reactii.
Stahl, fondatorul teoriei flogisticului, explica fermenatia ca un proces in care una din substantele prezente transmite "miscarea sa interna" substantei care fermenteaza (1697). În 1680, van Leeuwenhoeck a observat la microscop celulele drojdiei de bere, dar aceasta descoperire nu a fost luata in seama timp de doua secole. Lavoisier (1789) a facut un bilant de materiale al fermentatiei, aratand ca oxigenul, hidrogenul si carbonul din zahar se regasesc in alcoolul si bioxidul de carbon ce iau nastere. Continuarea acestor idei a condus la ecuatia lui Gay-Lussac a fermentatiei alcoolice.
Cagnard-Latour si, simultan si independent, Kützing (1838) au atribuit fermentatia alcoolica celulelor din drojdie, considerate ca fiinte vii, probabil de natura vegetala. În aceste observatii isi are originea teoria vitalista a fermentatiei. Sustinatorul principal al acestei teorii, Pasteur, a publicat in 1857 cercetarea sa celebra asupra fermentatiei alcoolice, in care sustine sau sugereaza ca fermentatia este un proces legat direct de metabolismul celulelor drojdiei. Liebig (1839) considera dimpotriva ca fermentatia este o descompunere a zaharului, datorita unor vibratii moleculare provocate de fenomenele chimice din celulele vii ale drojdiei.
În jumatatea a doua a secolului al IXX-lea, in urma lucrarilor lui Pasteur, multi chimisti faceau deosebire intre fermentii formati sau figurati presupusi legati inseparabil de anumite elemente din celule sau chiar considerati identici cu celula vie, si fermenti neformati sau solubili, de tipul acelora din sucurile digestive sau din extractele apoase ale diferitelor materiale biologice. Fermentii neformati sunt deci substante care isi exercita actiunea si in afara celulei vii. Termenul enzima, pentru a desemna fermentii neformati, a fost introdus de Kühne, in 1878.
Buchner (1897) a izolat din drojdia de bere un suc liber de orice celula si totusi capabil sa provoace fermentatia. Acest suc contine deci o enzima pe care Buchner a numit-o zimaza. Aceasta este de fapt un amestec de mai multe enzime, dupa cum s-a dovedit mai tarziu. În urma acestor descoperiri, deosebirea dintre termenii ferment si enzima a pierdut semnificatia sa. În cursul secolului al IXX-lea, au fost preparate multe extracte de enzime. Astfel, dupa ce Kirchoff a observat, in 1820, ca o componenta glutinoasa din bobul de orez incoltit, numit malt, transforma cantitati de amidon mult mai mari decat propria sa greutate, intr-un zahar solubil, maltoza, Dubrunfaut a gasit, in 1830, ca extractul apos, limpede, de malt are aceeasi actiune solubilizanta asupra amidonului ca maltul insusi. Din acest extract, Payen si Persoz (1833) au izolat prin precipitare cu etanol, prima enzima, amilaza, sub forma unui material solid alb, amorf, capabil sa solubilizeze o cantitate de amidon de 2000 de ori mai mare decat propria sa greutate. În 1830, Robiquet si Boutron-Chalard au descoperit hidroliza amigdalinei, cu extract de migdale amare, iar in 1837, Liebig si Wöhler au izolat enzima respectiva, numind-o emulsina. Printre primele enzime izolate, vom mai mentiona: pepsina din sucul gastric (Schwann, 1836); trepsina din sucul pancreatic (Kühne, 1848); lipaza (Claude Bernard , 1849); invertaza (Mitscherlich, 1841; Berthelot, 1860); ureeaza (Musculus, 1882), etc.
Un moment istoric deosebit de important este recunoasterea clara, de catre Berzelius, in 1835, a caracterului catalitic al reactiilor enzimatice, precum si a rolului esential pentru viata animalelor si a plantelor jucat de aceste reactii.
sursa:ipedia.ro






![Elemente Chimice - Argintul[Ag]](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEioGKEIrMvNL-w8-DxvYFPGHSMm2O7BHpRi4l5y3wxmjJQuvFlMm6XBeGJaSmz7w-UWUmEiOjP93IryUv4N8z2gi5wRxauxjChkT84P3bJt67K3SOLCPEK0QU91_rcMJh-ME3B9NrQ7r4I/s72-c/silver-chemistry-scheme-argint-poza-informatie-chimie-schema-referat-info-detalii-prelucrare-gasire-bijuterie.jpg)
0 comments: